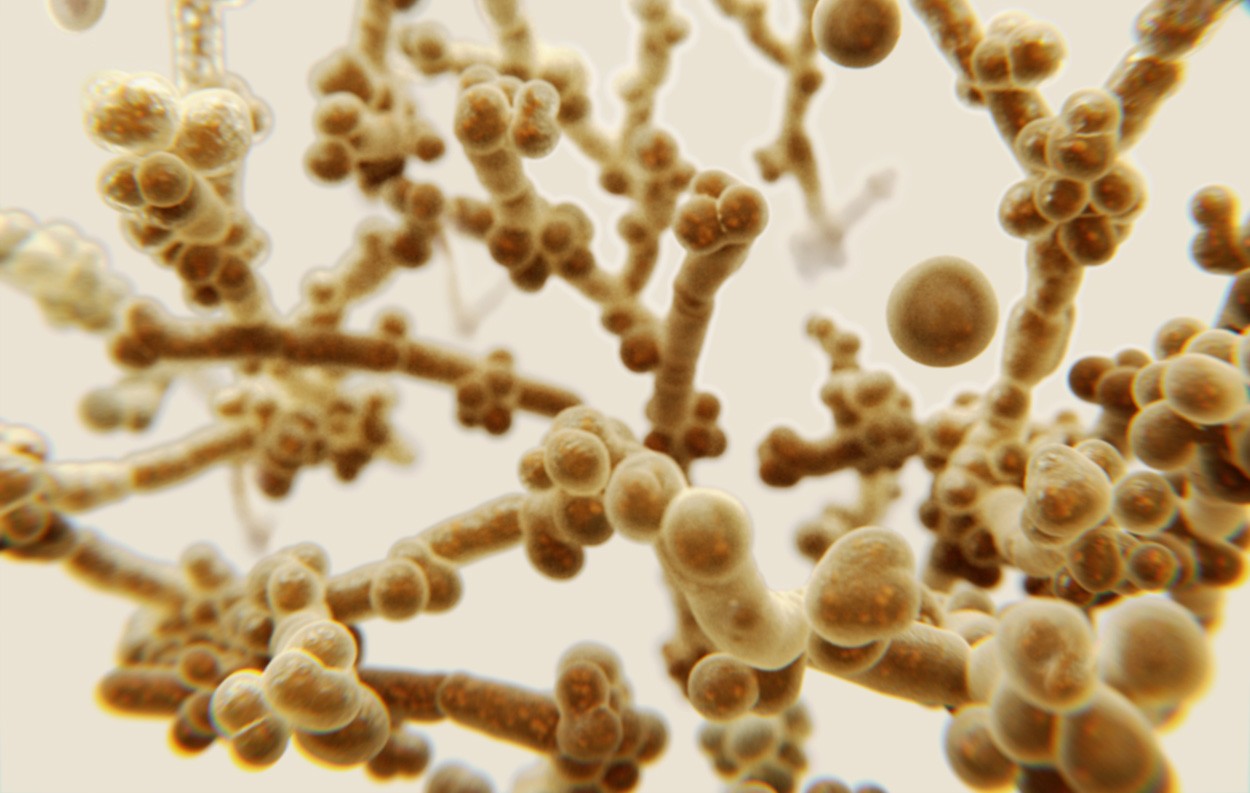
Desde su descubrimiento en 2009, la levadura Candida auris se ha convertido en un problema de salud creciente. Coloniza diversas superficies (desde la piel humana hasta dispositivos médicos) y es resistente a muchos fármacos. Para las personas con sistemas inmunológicos debilitados, una infección puede ser fatal. Los investigadores han revelado ahora el secreto del extraordinario poder adhesivo del hongo. Como resultado, una proteína adhesiva hasta ahora desconocida asegura una unión particularmente estable a las superficies y es crucial para la virulencia del hongo.
El patógeno Candida auris, resistente a múltiples fármacos, provoca peligrosas infecciones hospitalarias. El hongo se descubrió por primera vez en 2009 en el canal auditivo de un paciente japonés, donde provocó una infección de oído. El nombre «auris» proviene de la palabra latina que significa oreja. Aunque es inofensivo para las personas sanas, el hongo causa infecciones potencialmente mortales en personas inmunodeprimidas. Puede propagarse a grandes partes del cuerpo a través del torrente sanguíneo y dañar los órganos internos. Candida auris es resistente a la mayoría de los medicamentos utilizados para combatir las infecciones por hongos. Un problema adicional: la levadura se adhiere excepcionalmente bien a diversas superficies e incluso resiste algunos desinfectantes. De este modo puede depositarse, por ejemplo, en catéteres y otros dispositivos médicos y propagarse de esta manera.
Buscando rastros en el genoma
Para descubrir qué le da a Candida auris su poder adhesivo, un equipo dirigido por Darian Santana de la Universidad de Michigan comenzó a buscar pistas. Los investigadores primero observaron a los sospechosos habituales: las llamadas proteínas adhesinas, ya conocidas en otros hongos de levadura. Estas proteínas se encuentran en el exterior de las bacterias y los hongos y les permiten adherirse a las superficies. Utilizando métodos de ingeniería genética, Santana y su equipo eliminaron gradualmente todos los manuales de instrucciones de las proteínas adhesivas conocidas del genoma de Candida auris y probaron para cada mutante qué tan bien se adhiere a las superficies.
Los investigadores lograron eliminar once de las doce proteínas de adhesión conocidas de otras especies de Candida sin reducir la fuerza adhesiva de Candida auris. «Sólo la eliminación de la proteína de adhesión llamada IFF4109 dio como resultado una fuerza adhesiva ligeramente menor, pero sin impedir por completo la adhesión a las superficies», informan los investigadores. La responsable de la fuerza adhesiva debió ser otra proteína adhesiva que no había sido detectada ni descrita previamente en otras especies.
Aglutinantes como mejillones y percebes
En busca de esta misteriosa proteína, Santana y su equipo exploraron todo el genoma de Candida auris y finalmente descubrieron una nueva adhesina, a la que llamaron Factor de Colonización de Superficie (SCF1). «El nuevo adhesivo sólo está presente en C. auris, por lo que no sabemos de dónde vino evolutivamente», dice Teresa O’Meara, colega de Santana. A diferencia de las adhesinas fúngicas conocidas anteriormente, que se adhieren sólo mediante interacciones hidrófobas relativamente débiles, SCF1 forma enlaces particularmente fuertes, los llamados enlaces catión-pi.
«Gran parte de la literatura sobre estos tipos de enlaces en la naturaleza proviene de personas que intentan desarrollar un adhesivo que se adhiera bajo el agua», explica O’Meara. De hecho, el principio adhesivo del SCF1 es más similar al de los mejillones y los percebes. “En estado salvaje, Candida auris ha sido aislada de humedales costeros de las islas Andamán y de un estuario colombiano”, explica el equipo de investigación. «Esto sugiere un hábitat marino original, y este nicho ecológico puede haber ejercido la correspondiente presión selectiva sobre los mecanismos de adhesión».
La proteína adhesiva influye en la virulencia.
En experimentos con ratones, ratas y muestras de piel humana, el equipo demostró que SCF1 es efectivamente responsable de la fuerte adhesión y virulencia de la levadura. Si infectaban ratones inmunocomprometidos por vía intravenosa con el hongo, se producían daños graves al corazón y a los riñones en una semana. Sin embargo, los mutantes del hongo sin SCF1 causaron mucho menos daño a los órganos. Los mutantes en los que SCF1 se expresaba con especial intensidad tenían un efecto correspondientemente más destructivo. En experimentos posteriores, todos los ratones infectados con la variante virulenta de Candida auris murieron en un plazo de doce días. De los animales infectados con un mutante sin SCF1, ocho de cada diez seguían vivos después de tres semanas.
«Hasta ahora no sabemos por qué se necesita este adhesivo para causar enfermedades», dice O’Meara. “Tal vez sea necesario para la unión a los vasos sanguíneos, o tal vez altere las interacciones huésped-receptor, como es el caso del hongo relacionado Candida albicans. Pero en este caso aún no lo sabemos». Por lo tanto, al equipo le gustaría investigar más a fondo las conexiones entre SCF1 y la virulencia de Candida auris en estudios futuros. Esto podría conducir a nuevos enfoques para la terapia dirigida contra la enfermedad fúngica.
Fuente: Darian Santana (Universidad de Michigan, EE. UU.) et al., Science, doi: 10.1126/science.adf8972